Fém kémiai kötés 1
cél
- Adj egy ötlet kémiai kötés a fém.
- Tanulj meg írni áramköri lapok a fémes kötés.
- Ismeri a fémek fizikai tulajdonságainak.
- Ismerje meg, hogy egyértelmű különbséget a típusú kémiai kötéseket.
lecke célkitűzések
- Ismerje meg, hogyan hatnak a fém atomok
- Határozzuk meg, hogyan befolyásolja a fémes kötés alakul ki a tulajdonságait annak anyagok
Fontos kifejezések:
- Elektronegativitás - kémiai tulajdonság egy atom, amely a mennyiségi jellemző a képességét egy atom a molekulában, hogy vonzzák a megosztott elektronpár.
- Kémiai kötés jelenség kölcsönhatása atomok, mert az átfedés a elektron felhők a kölcsönható atomok.
- Fém kötés - egy atomok közötti kötés a fémek és ionok, következtében képződött megosztását elektronok.
- Kovalens kötés - a kémiai kötés által alkotott átfedőpár vegyérték elektronok. Visszacsatolás elektronok hívják teljes elektronpár. Van 2 féle poláros és nem poláros.
- Ionos kötéssel - a kémiai kötés, amely között van kialakítva nemetalov atomok, ahol a teljes elektronpár megy az atom egy nagyobb elektronegativitása. Ennek eredményeként, az atomok vonzott ellentétesen töltött testek.
- A hidrogénkötés - közötti kémiai kötés egy elektronegatív atom és hidrogénatom H, kovalensen kapcsolódik egy másik elektronegatív atommal. Mint egy elektronegatív atom szolgálhat N, O vagy F. A hidrogénkötések lehet intramolekuláris vagy intermolekuláris.
Fém kémiai kötés
Azonosítja azokat az elemeket, amelyek mára nem a „turn” .Pochemu?
Ca Fe P K Al Mg Na
Mik az elemek a periódusos hívják fémek?
Ma már tudjuk, hogy mely tulajdonságok vannak fémek, és függ a kapcsolat között alakul yonami fémek.
Először is, hadd mestoraspolazheniya fémek a periódusos?
Fémek mint tudjuk, nincs általában formájában izolált atomok, és abban a formában egy darab, öntvény vagy fém termékek. Tisztázni, hogy összegyűjti a fématomok az egész képernyőt.

Ábra. 1. Arany.
A példa azt látjuk, egy darab arany. És mellesleg egyedi fém arany. A kovácsolás tiszta aranyból lehet fólia vastagsága 0,002 mm! egy fólialap nonchayshy majdnem átlátszó, és egy zöld árnyalat lumen. Ennek eredményeként az arany rögök akkora, mint egy gyufásdoboz lehet beszerezni vékony fólia, amely kiterjed a terület egy teniszpálya.
Kémiailag, minden fémeket jellemzi a könnyű megtérülési vegyérték elektronok, és ennek következtében a kialakulását pozitív töltésű ionok, és hogy csak a pozitív oxidációs. Éppen ezért ezek a fémek szabad állapotban Studio Network. A közös jellemzője a fémek atom nagyméretű viszonyítva nemetalam. Külső ellektrony található nagy távolságra a sejtmagba, és ezért gyenge kapcsolatot, így könnyen lejön.
Az atomok nagy mennyiségű fémet a külső szinten kevés meglepő elektronok száma - 1,2,3. Ezek az elektronok könnyen leválasztható és a fématomok válnak ionokat.
Me0 - n e ⇆ Men +
atomok fém - E-Ext. pályára ⇆ fémionok
Így peremeschatsya lejöhet elektronok az egyik ion a másikra le lesz szabad, és hasonlók árukapcsolás őket egyetlen tseloe.Poetomu kiderül, hogy az összes elektron leszakad evlyaetsya általában, hiszen lehetetlen megérteni, hogyan ellektron tartozik fématomok.
Elektronok egyesült kationokkal, miközben átmenetileg atomok vannak kialakítva, amelyekből const, majd a levált elektronokat. Ez a folyamat zajlik folyamatosan, megszakítás nélkül. Kiderült, hogy a térfogata a fématomok válnak ionok folyamatosan, és fordítva. Amikor ez a kis számú elektront osztott kötődik számos fém atomok és ionok. De fontos, hogy az elektronok száma a fém egyenlő a teljes díjat a pozitív ionok, azaz kiderül, hogy általában a fém maradt elektromosan semleges.
Ezt a folyamatot képviseli, mint a minta - a fém ionok a felhőben az elektronok. Az ilyen elektron felhő az úgynevezett „elektron gáz”.
Itt például a képen látjuk, hogy milyen elektronchiki lépés között nepodvizhnyhyonov belülről kristályrács fém.
Ábra. 2. A mozgás az elektronok
Most tudjuk írni a definíció: a fémes kötés - egy kötés, ebben fémek közötti atomok és ionok képződnek megosztásával az elektronok.
A fémes kötés nem csak tiszta fémek, hanem jellemző keverékek különböző fémek, ötvözetek különböző állapotaiban aggregációt.
A fémes kötés fontos, és meghatározza az alapvető tulajdonságait fémek
- vezetőképesség - E-véletlenszerű mozgás az ömlesztett fém. De ha egy kis potenciál különbség. Az elektronok rendezett. A jobb vezetőképességet fémek Ag, Cu, Au, Al.
- hajlékonyság
Csatlakozások között a fém rétegek nem nagyon jelentős, ez lehetővé teszi, hogy mozog a rétegek terhelés alatt (deformálja a fém törés nélkül). Top deformálható fémek (lágy) Au, Ag, Cu.
- fémes csillogás
Elektrongáz tükrözi szinte minden fénysugarakat. Ezért annyira tiszta fémek fényét, és gyakran senryu vagy fehér. Fémek a legjobb reflektorok Ag, Cu, Al, Pd, Hg
Gyakorlat 1
Kiválasztás vegyületek, amelyek a következő általános képlettel
a) egy poláris kovalens kötés: Cl2, KCI, NH3, O2, MgO, CCI4, SO2;
b) egy ionos kötést: HCI, KBr, P4, H2S, Na2O, CO2, CaS.
2. gyakorlat
Kereszt a felesleges:
a) CuCl2, Al, MgS
b) N2, HCI, O2
a) Ca, CO2, Fe
g) MgCl2, NH3, H2
Érdekes tudni, hogy ...
Fém-nátriumot. lítium-fém, és egyéb alkálifémek változhat láng színe. Fém-lítium és ezek sói --krasny kölcsönöz láng színe, fémes nátrium és a nátrium - sárga, fém kálium és sói - lila, és a rubídium és cézium - is lila, de könnyebb.

Ábra. 4. Egy darab lítium-fém
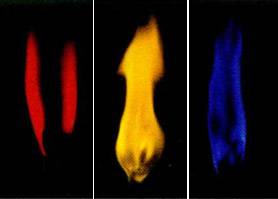
Ábra. 5. Staining fémek láng
Lítium (Li). A lítium-fém, mint fém nátrium, alkálifém. Mindkettő oldódik vízben. Nátrium, vízben oldjuk képez marónátron-nagyon erős savval. Amikor feloldásával alkálifémek a vízben sok hőt és a gáz (hidrogén). Ezek a fémek, kívánatos, hogy ne érjen, mert akkor megég.
Irodalom
Szerkesztette és elküldte Lisnyak AV
Fent a lecke dolgozott:
Felmerül a kérdés, a modern oktatás, hogy kifejezze egy elképzelés, hogy megoldja a fennálló problémát, akkor a Educational Forum. ahol nemzetközi oktatási fog szállni friss gondolatok és cselekvések. Azáltal, hogy a blog, akkor nem csak fokozza a státuszát, mint egy képzett oktató, hanem jelentős mértékben hozzájárul a fejlődés a jövőben iskola. Guild vezetők oktatási megnyitja kapuit a szakemberek a legmagasabb rangú, és felkéri, hogy együttműködnek létrehozása felé a legjobb iskola a világon.